Introducción:
En el sistema periódico los elementos están ordenados por su número atómico. Los elementos de un mismo grupo tienen propiedades químicas similares.
Los elementos de un mismo grupo tienen los mismos electrones de valencia.
Por ejemplo, todos los electrones del grupo 1 tienen un electrón en su
última capa, los del grupo 2 tienen 2 y los del grupo 17 tienen 7.
Las propiedades químicas de un elemento
están relacionadas con el número de electrones de valencia; Por eso, los
elementos de un mismo grupo tienen propiedades químicas similares.
El sistema periódico ha ido evolucionando desde que los griegos sugirieron la primera idea de clasificación de la materia hasta la actualidad.
Evolución del sistema periódico:
Como ya sabemos los griegos
fueron los primeros en plantearse una cierta clasificación de la
materia que les rodeaba. Así afirmaban la existencia de 4 elementos: aire, tierra, agua y fuego y 4 estados de la materia: frío, caliente, húmedo y seco.
Pero 22 siglos más tarde Döbereiner agrupó diversos elementos conocidos en su época en grupos de 3, a estos grupos se les denominó triadas,
están ordenados en cada una de ellas de tal modo que las propiedades
del elemento central son intermedias de las de los extremos o dicho de
otra manera con una variación gradual del primero al último, así puso de
manifiesto el notable parecido que había entre las propiedades de
ciertos grupos de 3 elementos, esto fue alrededor del año 1817.
Hacia el año 1827 observó que había otros 3 grupos en los cuales se cumplía esta relación estos eran:
- Cl,Br,I.
- S,Se, Te.
- Li,Na,K.
Hacia el año 1850 ya se habían encontrado unas 20 triadas, esto indicaba una cierta regularidad entre los elementos químicos.
En la imagen se muestran algunas de las triadas de Döbereiner:

Döbereiner intentó relacionar las
propiedades químicas de estos elementos con los pesos atómicos,
observando una gran relación entre ellos, y una variación gradual del
primero al último.
En su clasificación de las tríadas
explicaba que el peso atómico promedio de los pesos los elementos
extremos (suma de estos y división entre 2), es parecido, al peso
atómico del elemento del medio.
Ejemplo:
La triada Cloro, Bromo, Iodo, cuyos pesos atómicos son respectivamente 36, 80, 127.
36 + 127 = 163
163 / 2 =81,5 que está
cerca de 80 que es la masa atómica aproximada del bromo, lo que hace que
concuerde un aparente ordenamiento de las triadas.
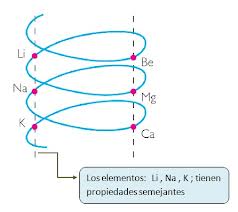
Poco después (hacia el año 1862) Chancourtois distribuyó los elementos en su caracol/tornillo/hélice/anillo telúric@
de tal modo que los elementos coincidentes en una generatriz formaban
una triada, los elementos Li, Na y K quedan a un lado y el Be, Mg y Ca a
otro. Los elementos de cada lado del caracol tienen propiedades similares.
A continuación se muestra el caracol telúrico de Chancourtois:
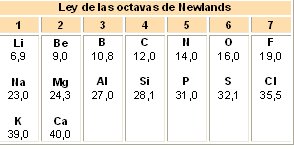
Más adelante hacia el año 1865 el químico inglés J.A Newlands que era un gran amante de la música, enunció una ley de octavas similar a la escala musical: “Si
se colocan todos los elementos en orden creciente de masas atómicas,
después de cada siete elementos aparece un octavo cuyas propiedades son
semejantes a las del primero”. Consiguió ordenar algunas filas,
pero no se conocían los gases nobles y no se encontraron sitios para los
elementos recién descubiertos.
En la siguiente tabla se muestra la ley de las octavas de Newlands:
Hacia 1869 los químicos L.Meyer y D.Mendeléiev
simultáneamente por separado organizaron los elementos conocidos según
masas atómicas crecientes observando la semejanza que había entre
aquellos de una misma columna.
Meyerse dio a sí mismo la tarea de crear la primera Tabla periódica de los elementos químicos. Pero cometió un error, no dejó un hueco cuando la ley descubierta no se cumplía por lo que si aparecía un elemento nuevo no lo podía colocar en su sistema periódico.
Mendeléiev “se llevó el merito” porque cuando en alguna ocasión la ley descubierta no se cumplía dejaba un huecopara un elemento desconocido, que al descubrirse tendría unas propiedades que anticipó. Al descubrirse el germanio y comprobarse que sus propiedades anticipadas coincidían extraordinariamente, la idea fue aceptada.
En esta imagen se muestra el sistema periódico de Mendeléiev:

Ya en el siglo XX alrededor de 1911 H.Mosseley ordenó los elementos conocidos según su número atómico Z creciente.
Alrededor de 1952 A.Werner y F.Paneth propusieron el sistema periódico actual, denominado el sistema periódico largo.
Sistema periódico actual:
En la actualidad el sistema periódico está formado por 116 elementos de los cuales los 5 últimos (ununnilio, unununio, ununbio, ununcuadio, ununhexio) su descubrimiento no ha sido confirmado por la IUPAC.En ella se distinguen metales, no metales, semimetales, hidrógeno y gases nobles, de los cuales hablaremos más adelante.
Si nos acercamos un poco podemos observar cuatro bloques:
- 2 columnas a la izquierda.
- 10 en el centro.
- 6 a la derecha.
- 2 filas abajo.
Los grupos tienen distintos nombres que son:
- Grupo 1: Metales alcalinos.
- Grupo 2: Alcalinoterreos.
- Grupos 3 y 13: Terreos.
- Grupo 14: Carbonoides o carbonoideos.
- Grupo 15: Nitrogenoides o nitrogenoideos.
- Grupo 16: Anfígenos.
- Grupo 17: Halógenos.
- Grupo 18: Gases nobles.
- Elementos centrales: Metales de transición.
- Lantánidos y actínidos: Tierras raras.
Cada uno de ellos coincide con el subnivel de la corteza electrónica que va sucesivamente siendo ocupado por los electrones.
Los bloques son los siguientes:
- Bloque s: Formado por los elementos de los grupos 1 y 2. Se caracterizan por ser metales ligeros (Salvo el H y el He que son gases). Su capa de valencia es del tipo ns1 o ns2.
- Bloque p: Comprende los elementos de los grupos 13 al 18. Estos elementos llenan los subniveles desde np1 hasta np6.
- Bloque d: Constituido por los elementos de los grupos 3 al 12(metales de transición).
- Bloque f: Denominados metales de transición interna o también tierras raras.
A pesar de que la tabla periódica es un extraordinario resumen de la química se le asignan al menos 4 inconvenientes:
- Posición del hidrógeno: Este elemento no tiene una casilla del todo adecuada a sus propiedades siendo por ello que se coloca en el centro de la tabla.
- Masas alternadas: Siendo la masa atómica creciente según el número atómico sin embargo hay varias parejas de elementos en las que el posterior tiene mayor masa que el anterior, como por ejemplo: cobalto – níquel, argón – potasio.
- Los lantánidos y actínidos: Deberían estar situados respectivamente en la casilla del lantano y en la del actinio, sin embargo ello implicaría una tabla periódica muy larga y estrecha, es decir, poco práctica, siendo por ello que se colocan en la parte de abajo de dicha tabla.
- La configuración electrónica: Un átomo está constituido por un núcleo y una corteza a base de electrones. La representación de los electrones de una corteza se conoce como estructura electrónica del átomo, y la estructura electrónica de menor energía se llama configuración electrónica. Los elementos de un mismo periodo se caracterizan por tener el mismo número de capas o niveles electrónicos mientras que los de un mismo grupo posee el mismo número de electrones en su última capa o nivel.
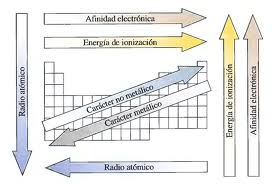
Se denominan propiedades períodicas a las propiedades de los elementos químicos que varían de modo sistemñatico a lo largo de la tabla periódica. A continuación veremos algunas de ellas.
Muchas de las propiedades de los elementos dependen de su configuración electrónica.
Se puede decir que la configuración electrónica es la propiedad más
importante de todas, ya que la química de los elementos depende de su
estructura electrónica, por lo que el conocimiento de una implica el
conocimiento de la otra. Aunque tiene bastantes excepciones, podemos
decir como norma general: Todos los elementos de un mismo período
introducen su electrón diferenciador en el mismo nivel, mientras que los
de un mismo grupo tienen el mismo número de electrones en el último
nivel.
- Radio atómico: El valor del radio atómico está relacionado con el tamaño de los átomos. Como la nube electrónica de cualquier átomo no tiene límite definido, el radio de un átomo no tiene un valor fijo. Suponiendo que los átomos se comportan como esferas en contacto con los átomos vecinos, se pueden emplear técnicas como la difracción de Rayos X, de neutrones o de electrones, para medir las distancias internucleares y calcular los radios atómicos a partir de ellas. El radio así medido depende de los átomos vecinos y del tipo de enlace. Por lo que podemos hablar de distintas formas de obtener el radio atómico según el tipo de enlace. El radio covalente se obtiene de la lonjitud del enlace entre dos átomos no metálicos unidos por un enlace covalente. El radio metálico se obtiene al dividir entre dos la distancia internuclear en un cristal metálico. El radio de van der Waals se determina midiendo lo próximos que se pueden colocar dos átomos no enlazados entre si en estado sólido (por ejemplo, en los gases nobles) y dividiendo entre dos la distancia internuclear.
- El radio atómico aumenta al descender en un grupo (al aumentar el valor de Z), debido a que aumenta el número de capas electrónicas.
- El radio iónico disminuye a lo largo de un período a medida que aumenta el número atómico, es decir, hacia la derecha. Aunque el nivel electrónico más externo es el mismo, al ir aumentando el número atómico aumentará el número de electrones periféricos, que estarán atraídos por una carga nuclear mayor no apantallada: aumenta la carga nuclear efectiva y el radio disminuye.
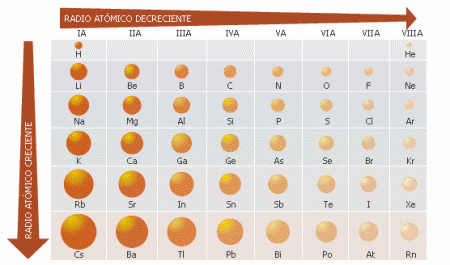
- Radio iónico: El radio de un ión es distinto del radio de un átomo en estado neutro, ya que el ión se forma por ganancia o pérdida de electrones.
- Los iones positivos tienen menor radio que los átomos neutros de los que proceden: Esta diminución de tamaño se debe a que cuando se forma el ión se pierden electrones, incluso en muchas ocasiones se pierde el nivel electrónico más externo, de modo que los demás electrones pueden reducir sus distancias, las repulsiones son menores.
- Los iones negativos tienen mayor radio atómico que los átomos neutros de los que proceden: porque al ganar electrones aumenta la repulsión interelectrónica.
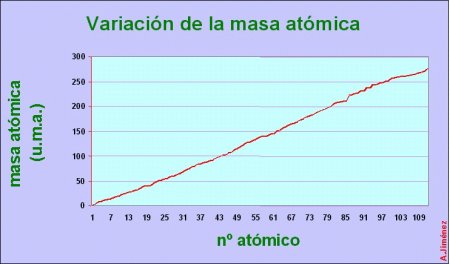
- Masa atómica: Dado que consiste en la suma de protones + neutrones de un átomo, la masa de estos en la Tabla Periódica, aumente de izquierda a derecha y de arriba abajo en un grupo teniendo en cuenta algunas excepciones(cobalto-niquel, argón-potásio, telurio-iodo…).
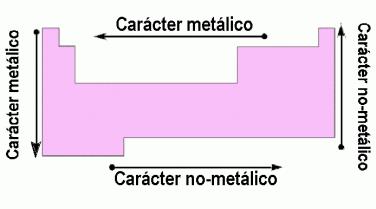
- Caracter metálico: En química se entiende por metal el elemento electro-positivo. Es decir aquel que por tener pocos electrones en su último nivel tiene tendencia a perderlos es decir cargarse positivamente. Esta aumenta de derecha a izquierda en un periodo y de arriba abajo en un grupo.
- Caracter no metálico: Se entiende por no metal el elemento electronegativo. Es decir aquel que por tener muchos electrónes en su último nivel tiene tendencia a ganar el pequeño número que le falta de ellos para adquirir configuración de gas noble. Es decir la más estable, cargandose por ello negativamente. En la Tabla Periódica el caracter no metálico varia exactamente al contrario que el metálico, es decir, aumenta hacia la derecha en un periodo y hacia arriba en un grupo.
- Energía de ionización: Es
la energía necesaria para arrancar un electrón a un átomo en fase
gaseosa y en estado fundamental. En un mismo átomo existen primera
energía de ionización, segunda, tercera, cuarta … que van aumentando ya
que cada vez el núcleo atrae con más fuerza a los electrones y estos son
más dificiles de arrancar. Se suele expresar en KJ/mol, Kcal/mol o en
ev/átomo. Cuanto menor sea la energía de ionización de un átomo más
fácil será que pierda electrones para formar iones positivos (más
electropositivo).
Aunque surgen algunas irregularidades debidas al aumento de estabilidad cuando algunos orbitales están llenos o semillenos, en general:
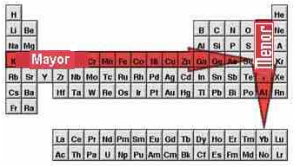
- Al descender en un grupo disminuye la energía de ionización, pues al aumentar el número de capas de electrones aumentan el apantallamiento del núcleo y el radio atómico, de hecho que los electrones están menos atraídos y son más fáciles de arrancar.
- Dentro de un mismo período, la energía de ionización aumenta hacia la derecha al aumentar el número atómico, pues al aumentar la carga nuclear efectiva los electrones están más atraídos y son más difíciles de arrancar.
- Afinidad electrónica o electroafinidad: Es la energía que hay que darle a un átomo en fase gaseosa y en estado fundamental para que gane un electrón y se convierta en un ión negativo gaseoso. Los elementos con afinidades electrónicas muy negativas ganan fácilmente un electrón para convertirse en aniones. Se expresa en KJ/mol, Kcal/mol o en ev/átomo. Existen electroafinidades segunda, tercera, etc. que implican un acercamiento de energía por lo que los electrones ya captados ejercen una fuerza de repulsión sobre los nuevos que se capten.
- Disminuye al descender en un grupo: Pues al aumentar el número de capas de electrones aumentan el apantallamiento del núcleo y el radio atómico, por lo que el núcleo tiene menos tendencia a captar un electrón externo y se desprende menos energía cuando lo capta.
- Aumenta hacia al derecha de un mismo período al aumentar el número atómico (excepto en los gases nobles): La razón es que, al avanzar hacia la derecha en un período aumenta la carga nuclear efectiva, además de estar cerca de adquirir configuración de gas noble. Así pues, existe más tendencia a captar electrones y mayor desprendimiento de energía cuando esto ocurre.
Resumen de las propiedades periódicas:
Propiedades de los elementos del sistema periódico:
Como ya hemos mencionado, en el sistema periódico se distinguen: Metales, no metales, semimetales e hidrógeno.Lo que haremos en este capítulo será estudiar sus propiedades:
- Metales: Constituyen el grupo mayoritario de los elementos; están situados a la izquierda y en el centro del sistema periódico. Tienen brillo metálico, son sólidos a temperatura ambiente, excepto el mercurio que es líquido, son maleables (pueden formar láminas con facilidad) y dúctiles (pueden formar hilos) y son buenos conductores del calor y la electricidad por ejemplo Na, Ca…Tienen tendencia a formar iones positivos (cationes) por ejemplo Na+,Ca+…
- No metales: Están situados en la región superior derecha del sistema periódico. Son malos conductores del calor y la electricidad. A temperatura ambiente, hay no metales gaseosos(N,F,Cl), líquidos (Br) y sólidos(S). Ejemplos de no metales: C, N, P. Tienen tendencia a formar iones negativos (aniones) por ejemplo N3-,O-2…
- Semimetales: Están situados en el sistema periódico entre los metales y los no metales. Son elementos semimetálicos B, Si, Ge, As. Son sólidos a temperatura ambiente. Forman iones positivos aunque con dificultad.
- El hidrógeno: Es el elemento que tiene una estructura más simple: su átomo consta de un protón y un electrón. No tiene las propiedades características de ningún grupo de elementos, ni se le puede asignar una posición definida en el sistema periódico. Puede formar iones positivos H+ y negativos H-.
- Los gases nobles: Están situados en la columna derecha del sistema periódico. Se caracterizan porque en condiciones normales son inertes: no reaccionan con ningún otro elemento y no forman iones estables. Los gases nobles son: helio, neón, argón, criptón y xenón.


No hay comentarios:
Publicar un comentario